Действующий
9.3.10. Ацетат меди (II), х.ч. или ч.д.а., по ГОСТ 5852-79, насыщенный раствор: 8 - 9 г ацетата меди (II) растворяют в 100  дистиллированной воды.
дистиллированной воды.
9.4.1. Реактив Фелинга. Состоит из двух растворов. Оба раствора хранят отдельно и смешивают равные их объемы перед употреблением. Разделение и хранение растворов вызвано тем, что двухвалентная медь способна медленно окислять калий-натрий виннокислый в щелочной среде с выделением осадка закиси меди.
Раствор Фелинга 1 (по Бертрану). Исходным реактивом является сульфат меди (II) ( ), х.ч. или ч.д.а., по ГОСТ 4165-76: 40 г перекристаллизованного, не содержащего железа, сульфата меди (II) растворяют в дистиллированной воде в мерной колбе вместимостью 1000
), х.ч. или ч.д.а., по ГОСТ 4165-76: 40 г перекристаллизованного, не содержащего железа, сульфата меди (II) растворяют в дистиллированной воде в мерной колбе вместимостью 1000  . Для перекристаллизации 70 г сульфата меди (II) растворяют, при нагревании, в 100
. Для перекристаллизации 70 г сульфата меди (II) растворяют, при нагревании, в 100  дистиллированной воды. К раствору добавляют 1 - 2 капли концентрированной азотной кислоты на каждые 100
дистиллированной воды. К раствору добавляют 1 - 2 капли концентрированной азотной кислоты на каждые 100  раствора для окисления возможной примеси железа, доводят до кипения и горячий раствор фильтруют через складчатый фильтр; при этом можно пользоваться воронкой для горячего фильтрования. Фильтрат охлаждают. Для освобождения образовавшихся в фильтрате кристаллов сульфата меди (II) раствор фильтруют через стеклянный фильтр с помощью водоструйного насоса или сливают декантацией. Кристаллы сульфата меди (II) отжимают и высушивают между листами фильтровальной бумаги.
раствора для окисления возможной примеси железа, доводят до кипения и горячий раствор фильтруют через складчатый фильтр; при этом можно пользоваться воронкой для горячего фильтрования. Фильтрат охлаждают. Для освобождения образовавшихся в фильтрате кристаллов сульфата меди (II) раствор фильтруют через стеклянный фильтр с помощью водоструйного насоса или сливают декантацией. Кристаллы сульфата меди (II) отжимают и высушивают между листами фильтровальной бумаги.
Раствор Фелинга 2 (по Бертрану). Исходными реактивами являются тартрат калия-натрия (сегнетова соль)  , х.ч., по ГОСТ 5845-70 и гидроксид натрия (NaOH), х.ч. или ч.д.а., по ГОСТ 4326-77: 200 тартрата калия-натрия взвешивают с точностью до 0,01 г, растворяют при слабом нагревании в 300 - 400
, х.ч., по ГОСТ 5845-70 и гидроксид натрия (NaOH), х.ч. или ч.д.а., по ГОСТ 4326-77: 200 тартрата калия-натрия взвешивают с точностью до 0,01 г, растворяют при слабом нагревании в 300 - 400  дистиллированной воды, прибавляют 150 г гидроксида натрия или 200 г гидроксида калия, растворенного в 300 - 350
дистиллированной воды, прибавляют 150 г гидроксида натрия или 200 г гидроксида калия, растворенного в 300 - 350  дистиллированной воды в фарфоровом стакане, и охлаждают. Оба раствора количественно переносят в мерную колбу вместимостью 1000
дистиллированной воды в фарфоровом стакане, и охлаждают. Оба раствора количественно переносят в мерную колбу вместимостью 1000  и доводят дистиллированной водой до метки.
и доводят дистиллированной водой до метки.
9.4.2. Раствор сульфата аммония железа (III) (железоаммонийные квасцы). Исходным реактивом является сульфат аммония железа (III)  , х.ч. или ч.д.а., по ГОСТ 4205-77; 86 г квасцов растворяют в фарфоровом стакане в 600 - 700
, х.ч. или ч.д.а., по ГОСТ 4205-77; 86 г квасцов растворяют в фарфоровом стакане в 600 - 700  воды и осторожно добавляют 200 г (108
воды и осторожно добавляют 200 г (108  ) концентрированной серной кислоты. После охлаждения раствор переносят в мерную колбу на 1
) концентрированной серной кислоты. После охлаждения раствор переносят в мерную колбу на 1  доводят до метки водой и перемешивают. Раствор квасцов не должен содержать соли железа (II); при добавлении к 20
доводят до метки водой и перемешивают. Раствор квасцов не должен содержать соли железа (II); при добавлении к 20  раствора 1 - 2 капель перманганата калия розовая окраска должна сохраняться в течение 1 мин. Если окраска исчезает сразу, раствор квасцов окисляют перманганатом калия до появления устойчивой слабо-розовой окраски.
раствора 1 - 2 капель перманганата калия розовая окраска должна сохраняться в течение 1 мин. Если окраска исчезает сразу, раствор квасцов окисляют перманганатом калия до появления устойчивой слабо-розовой окраски.
9.4.3. Перманганат калия. 0,02 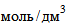 (0,1 н) раствор. Исходными реактивами являются перманганат калия
(0,1 н) раствор. Исходными реактивами являются перманганат калия  , х.ч, по ГОСТ 20490-75, оксалат аммония, х.ч., по ГОСТ 5712-78, или оксалат натрия, х.ч. или ч.д.а., по ГОСТ 5839-77, или щавелевая кислота, х.ч. или ч.д.а., по действующей нормативно-технической документации: 3,16 г перманганата калия растворяют в прокипяченной (для удаления
, х.ч, по ГОСТ 20490-75, оксалат аммония, х.ч., по ГОСТ 5712-78, или оксалат натрия, х.ч. или ч.д.а., по ГОСТ 5839-77, или щавелевая кислота, х.ч. или ч.д.а., по действующей нормативно-технической документации: 3,16 г перманганата калия растворяют в прокипяченной (для удаления  и
и  ) горячей дистиллированной воде в мерной колбе вместимостью 1000
) горячей дистиллированной воде в мерной колбе вместимостью 1000  . Раствор охлаждают до 20°C и доводят водой до метки. Подготовленный таким образом раствор можно употреблять на следующий день. Раствор хранят в склянке из темного стекла.
. Раствор охлаждают до 20°C и доводят водой до метки. Подготовленный таким образом раствор можно употреблять на следующий день. Раствор хранят в склянке из темного стекла.
Для установления титра раствора перманганата калия на аналитических весах на часовом стекле взвешивают 0,1400 г перекристаллизованного оксалата аммония, переносят количественно в коническую колбу и растворяют в 100  воды; добавляют в колбу 2
воды; добавляют в колбу 2  концентрированной серной кислоты, раствор нагревают до 80°C на водяной бане и титруют из бюретки раствором перманганата калия при постоянном помешивании до появления розовой окраски, не исчезающей в течение 1 мин. Раствор до окончания титрования должен быть горячим.
концентрированной серной кислоты, раствор нагревают до 80°C на водяной бане и титруют из бюретки раствором перманганата калия при постоянном помешивании до появления розовой окраски, не исчезающей в течение 1 мин. Раствор до окончания титрования должен быть горячим.
Примечание. Титр раствора перманганата калия устанавливают также по оксалату натрия (предварительно освобожденному от гигроскопической воды путем нагревания при 120°C) или по свежеперекристаллизированной щавелевой кислоте с соблюдением тех же условий выполнения, что и при использовании оксалата аммония. При вычислении титра, в случае применения оксалата натрия, следует вместо коэффициента 0,8951 в формулу вводить 0,9488, а в случае применения щавелевой кислоты - 1,0086. Желательно титр устанавливать по двум реактивам (кислоте и аммонию), добиваясь идентичных результатов.
9.4.4. Щелочной медно-цитратный раствор. Исходными реактивами являются сульфат меди (II), х.ч. или ч.д.а., по ГОСТ 4165-78, лимонная кислота ( ), х.ч., по ГОСТ 3652-69 и карбонат натрия безводный (
), х.ч., по ГОСТ 3652-69 и карбонат натрия безводный ( ) или кристаллогидрат (
) или кристаллогидрат ( ), х.ч. или ч.д.а., по ГОСТ 83-79: 25 г сульфата меди (II) растворяют в 100
), х.ч. или ч.д.а., по ГОСТ 83-79: 25 г сульфата меди (II) растворяют в 100  дистиллированной воды; 50 г лимонной кислоты растворяют отдельно в 50
дистиллированной воды; 50 г лимонной кислоты растворяют отдельно в 50  дистиллированной воды, 388 г кристаллогидрата карбоната натрия или 143,7 г безводного карбоната натрия также растворяют отдельно в 300 - 500
дистиллированной воды, 388 г кристаллогидрата карбоната натрия или 143,7 г безводного карбоната натрия также растворяют отдельно в 300 - 500  горячей воды. Раствор лимонной кислоты осторожно вливают небольшими порциями в охлажденный раствор карбоната натрия. После прекращения выделения углекислого газа смесь растворов переносят в мерную колбу вместимостью 1000
горячей воды. Раствор лимонной кислоты осторожно вливают небольшими порциями в охлажденный раствор карбоната натрия. После прекращения выделения углекислого газа смесь растворов переносят в мерную колбу вместимостью 1000  , вливают в колбу раствор сульфата меди (II), доводят содержимое колбы дистиллированной водой до метки, перемешивают и, если нужно, фильтруют.
, вливают в колбу раствор сульфата меди (II), доводят содержимое колбы дистиллированной водой до метки, перемешивают и, если нужно, фильтруют.
9.4.5. Тиосульфат натрия (гипосульфит), 0,1  (0,1 н) раствор. Исходным реактивом является тиосульфат натрия (
(0,1 н) раствор. Исходным реактивом является тиосульфат натрия ( ), х.ч. или ч.д.а., по ГОСТ 4215-66: 25 г тиосульфата натрия взвешивают с точностью до 0,1 г, переносят в мерную колбу вместимостью 1000
), х.ч. или ч.д.а., по ГОСТ 4215-66: 25 г тиосульфата натрия взвешивают с точностью до 0,1 г, переносят в мерную колбу вместимостью 1000  , растворяют в свежепрокипяченной и охлажденной, без доступа углекислоты, воде. Охлаждают воду в колбе с закрытой пробкой, через которую проходит хлоркальциевая трубка, наполненная натронной известью. В колбу с раствором прибавляют 0,2 г безводного карбоната натрия и доводят объем раствора до метки той же водой. Раствор хранят в склянке из темного стекла.
, растворяют в свежепрокипяченной и охлажденной, без доступа углекислоты, воде. Охлаждают воду в колбе с закрытой пробкой, через которую проходит хлоркальциевая трубка, наполненная натронной известью. В колбу с раствором прибавляют 0,2 г безводного карбоната натрия и доводят объем раствора до метки той же водой. Раствор хранят в склянке из темного стекла.
Коэффициент поправки устанавливают через 8 - 15 дней по 0,017  (0,1 н) раствору бихромата калия (п. 9.3.2). Раствор можно приготовить из фиксанала, растворяя содержимое ампулы свежепрокипяченной и охлажденной до 20°C водой. Затем раствор доводят той же водой до метки. В этом случае поправочный коэффициент не устанавливают. Рекомендуется готовить запас раствора тиосульфата натрия в количестве 5 - 10
(0,1 н) раствору бихромата калия (п. 9.3.2). Раствор можно приготовить из фиксанала, растворяя содержимое ампулы свежепрокипяченной и охлажденной до 20°C водой. Затем раствор доводят той же водой до метки. В этом случае поправочный коэффициент не устанавливают. Рекомендуется готовить запас раствора тиосульфата натрия в количестве 5 - 10  .
.
Для установления поправочного коэффициента 0,1  (0,1 н) раствора тиосульфата натрия в коническую колбу с притертой пробкой или в обычную коническую колбу, закрывающуюся часовым стеклом, из бюретки или пипеткой приливают точно 20
(0,1 н) раствора тиосульфата натрия в коническую колбу с притертой пробкой или в обычную коническую колбу, закрывающуюся часовым стеклом, из бюретки или пипеткой приливают точно 20  0,017
0,017  (0,1 н) раствора бихромата калия (п. 9.3.2), доливают водой примерно до 100
(0,1 н) раствора бихромата калия (п. 9.3.2), доливают водой примерно до 100  , прибавляют, при помешивании, примерно 4
, прибавляют, при помешивании, примерно 4  концентрированной серной колоты и 4
концентрированной серной колоты и 4  йодида калия, раствор с массовой долей 30% (п. 9.3.6). Колбу закрывают пробкой или часовым стеклом и оставляют в темном месте на 2 - 3 мин. Затем содержимое колбы титруют раствором тиосульфата натрия, все время интенсивно перемешивая жидкость, пока коричневый цвет раствора не перейдет в светло-желтый. Далее прибавляют 1
йодида калия, раствор с массовой долей 30% (п. 9.3.6). Колбу закрывают пробкой или часовым стеклом и оставляют в темном месте на 2 - 3 мин. Затем содержимое колбы титруют раствором тиосульфата натрия, все время интенсивно перемешивая жидкость, пока коричневый цвет раствора не перейдет в светло-желтый. Далее прибавляют 1  раствора крахмала с массовой долей 1% и продолжают титрование до исчезновения синей окраски и появления зеленоватой окраски соединений трехвалентного хрома. Поправочный коэффициент (К) к точно 0,1
раствора крахмала с массовой долей 1% и продолжают титрование до исчезновения синей окраски и появления зеленоватой окраски соединений трехвалентного хрома. Поправочный коэффициент (К) к точно 0,1  (0,1 н) раствору находят по формуле:
(0,1 н) раствору находят по формуле:
9.4.6. Гексацианоферрат (III) калия (красная кровяная соль), титрованный раствор с массовой долей 1%. Исходным реактивом является гексацианоферрат (III) калия  , х.ч. или ч.д.а., по ГОСТ 4206-75: 10 г гексацианоферрата (III) калия переносят в мерную колбу вместимостью 1000
, х.ч. или ч.д.а., по ГОСТ 4206-75: 10 г гексацианоферрата (III) калия переносят в мерную колбу вместимостью 1000  , растворяют в дистиллированной воде и доводят до метки.
, растворяют в дистиллированной воде и доводят до метки.
Коэффициент поправки устанавливают следующим образом. В коническую колбу вместимостью 250  с притертой или каучуковой пробкой отбирают пипеткой 50
с притертой или каучуковой пробкой отбирают пипеткой 50  раствора гексацианоферрата (III) калия с массовой долей 1%, затем прибавляют 20
раствора гексацианоферрата (III) калия с массовой долей 1%, затем прибавляют 20  раствора сульфата цинка с массовой долей 10%, не содержащего железа, и 20
раствора сульфата цинка с массовой долей 10%, не содержащего железа, и 20  раствора йодида калия с массовой долей 20%, не содержащего свободного йода. Содержимое взбалтывают в закрытой колбе и тотчас же титруют выделившийся йод 0,1
раствора йодида калия с массовой долей 20%, не содержащего свободного йода. Содержимое взбалтывают в закрытой колбе и тотчас же титруют выделившийся йод 0,1  (0,1 н) раствором тиосульфата натрия в присутствии крахмала в качестве индикатора до его обесцвечивания. Поправку (К) вычисляют по формуле:
(0,1 н) раствором тиосульфата натрия в присутствии крахмала в качестве индикатора до его обесцвечивания. Поправку (К) вычисляют по формуле:
V - объем точно 0,1  (0,1 н) раствора тиосульфата натрия, пошедшего на титрование выделившегося йода,
(0,1 н) раствора тиосульфата натрия, пошедшего на титрование выделившегося йода,  ;
;
0,03291 - количество гексацианоферрата (III) калия, соответствующее 1  0,1
0,1  (0,1 н) раствора тиосульфата натрия, г;
(0,1 н) раствора тиосульфата натрия, г;
0,5 - количество гексацианоферрата (III) калия, содержащегося в 50  точно раствора с массовой долей 1%.
точно раствора с массовой долей 1%.
9.5. Основные растворы для определения содержания витамина С, сернистого ангидрида и достаточности термической обработки
9.5.1. Натриевая соль 2,6-дихлорфенолиндофенола (индикатор), 0,001  (0,001 н) раствор. Исходными реактивами являются натриевая соль 2,6-дихлорфенолиндофенола, сульфат аммоний железа (II) или соль Мора
(0,001 н) раствор. Исходными реактивами являются натриевая соль 2,6-дихлорфенолиндофенола, сульфат аммоний железа (II) или соль Мора  , х.ч., по ГОСТ 4208-72; оксалат натрия, х.ч., по ГОСТ 5839-77 или оксалат аммония, х.ч., по ГОСТ 5712-78: 0,2000 г индикатора растворяют в 700
, х.ч., по ГОСТ 4208-72; оксалат натрия, х.ч., по ГОСТ 5839-77 или оксалат аммония, х.ч., по ГОСТ 5712-78: 0,2000 г индикатора растворяют в 700  дистиллированной воды при энергичном взбалтывании и добавляют 300
дистиллированной воды при энергичном взбалтывании и добавляют 300  фосфатного буферного раствора.
фосфатного буферного раствора.
Приготовленный раствор фильтруют и хранят в склянке из темного стекла в темном месте в течение 1 - 1,5 месяца.
Поправку к титру устанавливают 1 раз в неделю по 0,01  (0,01 н) раствору соли Мора. В коническую колбу вместимостью 50 - 100
(0,01 н) раствору соли Мора. В коническую колбу вместимостью 50 - 100  наливают пипеткой 10
наливают пипеткой 10  приготовленного раствора индикатора, добавляют 5
приготовленного раствора индикатора, добавляют 5  насыщенного раствора оксалата натрия (7 г на 100
насыщенного раствора оксалата натрия (7 г на 100  воды) или аммония и титруют из микробюретки или микропипетки 0,01
воды) или аммония и титруют из микробюретки или микропипетки 0,01  (0,01 н) раствором соли Мора до отчетливого перехода синей окраски в лимонно-желтую (нерезкая перемена окраски указывает на непригодность реактива).
(0,01 н) раствором соли Мора до отчетливого перехода синей окраски в лимонно-желтую (нерезкая перемена окраски указывает на непригодность реактива).

 , (114)
, (114)