Действующий
Проведение испытания. Тарелку протирают полоской фильтровальной бумаги размером 15 x 15 мм, которую затем смачивают несколькими каплями специального реактива (см. раздел 9, п. 9.6.13) и через 10 с промывают холодной водой. При наличии на тарелке жира бумага окрашивается в желтый цвет, при отсутствии - в сероватый или голубоватый. Метод позволяет определить 0,2 - 0,5 мг жира на шероховатой поверхности пластмассовой тарелки.
Допускается на пищевом объекте брать только "бумажные пробы", а окрашивание их производить в лаборатории.
Метод основан на определении количества жира, оставшегося на посуде, с помощью полосок из белой хлопчатобумажной ткани, смоченных эфиром.
Аппаратура, материалы, реактивы. Полоски белой хлопчатобумажной ткани, эфир этиловый; метиленовый голубой, раствор с массовой долей 0,01%.
Проведение испытания. Полоской (рис. 7), смоченной эфиром и укрепленной на основании корковой пробки, протирают поверхность тарелки. После высушивания на воздухе полоску окрашивают. Для этого ее осторожно кладут на поверхность раствора метиленового голубого с массовой долей 0,01% так, чтобы она смачивалась только с нижней стороны. При наличии жира на полоске остается круглое неокрашенное пятно, имеющее форму основания пробки. При отсутствии жира полоска окрашивается в синий цвет равномерно (рис. 7а). По величине неокрашенной части полоски можно судить о степени загрязнения посуды. Чем больше жира осталось на посуде, тем отчетливее и больше неокрашенное пятно.

|
|
| 534 × 285 пикс. Открыть в новом окне | |
При отсутствии белого пятна посуду следует считать чистой и записывать в протоколе (акте) "обезжирена" или обозначать знаком минус (-).
Наличие на полоске отчетливого светлого пятна величиной с 1 - 2 спичечные головки или слабо заметного пятна неполного круга свидетельствует о незначительном загрязнении посуды (первая степень) и обозначается знаком "+". Если светлое пятно достигает 1/3 или 1/2 размера круга, загрязнение посуды относится ко второй степени и обозначается знаком "++". При третьей степени загрязнения на полоске отчетливо выявляется светлое пятно полного диаметра основания пробки, что обозначается знаком "+++".
Метиленовый голубой может быть заменен обычными анилиновыми чернилами в соответствующей концентрации (0,01%). Вместо хлопчатобумажных полосок можно воспользоваться фильтровальной бумагой, однако чувствительность и точность метода при этом значительно снижается.
8.2.5. Контроль качества мытья столовой посуды после обработки ее водой с хлорсодержащими препаратами
При проведении по тарелке ватным тампоном, смоченным раствором йодистокалиевого крахмала, появляется полоса буровато-синего цвета. Если тарелки вымыты без применения хлорной извести, то цветная полоса не появляется.
Аппаратура, материалы, реактивы. Полоски хлопчатобумажные; ватные тампончики на спичках; лупа; эфир этиловый.
Проведение испытания. Качество мытья вилок можно определять так же, как и тарелок, протирая их хлопчатобумажными полосками, смоченными эфиром (см. с. 265). Кроме того, для обнаружения остатков пищи между зубцами можно использовать лупу и ватные тампончики на спичках. Тампончиком протирают вилку между зубцами и затем рассматривают прилипшие к нему частички пищи в лупу. Для проверки следует брать не менее 10 вилок. При обнаружении хотя бы одной частички пищи вилки считаются плохо вымытыми.
Аппаратура, материалы, реактивы. Весы лабораторные; бюкса стеклянная; колба коническая вместимостью 200  с притертой пробкой; цилиндр измерительный вместимостью 50
с притертой пробкой; цилиндр измерительный вместимостью 50  ; бюретка вместимостью 50
; бюретка вместимостью 50  ; пипетка вместимостью 2
; пипетка вместимостью 2  ; кислота серная, раствор с массовой долей 20%; йодид калия, раствор с массовой долей 10%; тиосульфат натрия, раствор 0,1
; кислота серная, раствор с массовой долей 20%; йодид калия, раствор с массовой долей 10%; тиосульфат натрия, раствор 0,1  ; крахмал растворимый, раствор массовой долей 1%; вода дистиллированная.
; крахмал растворимый, раствор массовой долей 1%; вода дистиллированная.
Проведение испытания. Навеску порошка хлорной извести около 2 г (точность до 0,001 г) в стеклянной бюксе количественно переносят в коническую колбу вместимостью 200  с притертой пробкой, при трехкратном ополаскивании бюксы заранее отмеренными 50
с притертой пробкой, при трехкратном ополаскивании бюксы заранее отмеренными 50  дистиллированной воды. Содержимое колбы перемешивают в течение 1 мин, затем добавляют 20
дистиллированной воды. Содержимое колбы перемешивают в течение 1 мин, затем добавляют 20  раствора серной кислоты с массовой долей 20% и 20
раствора серной кислоты с массовой долей 20% и 20  раствора йодида калия с массовой долей 10%.
раствора йодида калия с массовой долей 10%.
Колбу закрывают пробкой, осторожно взбалтывают и ставят на 5 мин в темное место. Выделившийся йод титруют раствором тиосульфата натрия с концентрацией 0,1  (0,1 н) до соломенно-желтого цвета. После этого добавляют 1
(0,1 н) до соломенно-желтого цвета. После этого добавляют 1 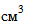 раствора крахмала с массовой долей 1% и дотитровывают до полного обесцвечивания раствора.
раствора крахмала с массовой долей 1% и дотитровывают до полного обесцвечивания раствора.
По Санитарным правилам, утвержденным Министерством здравоохранения СССР, в воде второй моечной ванны должно содержаться 0,2% хлорной извести или 0,2% хлорамина. Для этого необходимо вносить 200  осветленного раствора хлорной извести с массовой долей 10% или 20 г хлорамина на 10 л воды (1 ведро).
осветленного раствора хлорной извести с массовой долей 10% или 20 г хлорамина на 10 л воды (1 ведро).
Обычно готовят раствор хлорной извести с массовой долей 10%, а затем осветленный раствор разводят, как указано выше, и получают требуемое содержание хлорной извести.
9.1.1. Серная кислота. Исходным раствором является концентрированная серная кислота ( ), х.ч., по ГОСТ 4204-77, плотностью 1,84
), х.ч., по ГОСТ 4204-77, плотностью 1,84 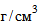 . Плотность кислоты необходимо проверять с помощью ареометра.
. Плотность кислоты необходимо проверять с помощью ареометра.
2  (4 н) раствор. Отмеряют мерным цилиндром III
(4 н) раствор. Отмеряют мерным цилиндром III  концентрированной серной кислоты. Осторожно, небольшими порциями, при охлаждении, приливают ее к дистиллированной воде. После охлаждения объем доводят до 1000
концентрированной серной кислоты. Осторожно, небольшими порциями, при охлаждении, приливают ее к дистиллированной воде. После охлаждения объем доводят до 1000  .
.
0,5  (1 н) раствор. Отмеривают мерным цилиндром 27,8
(1 н) раствор. Отмеривают мерным цилиндром 27,8  концентрированной серной кислоты и разбавляют дистиллированной водой до 1000
концентрированной серной кислоты и разбавляют дистиллированной водой до 1000  , как указано выше.
, как указано выше.
0,05  (0,1 н) раствор. Для его приготовления 2
(0,1 н) раствор. Для его приготовления 2  (4 н) или 0,5
(4 н) или 0,5  (1 н) растворы разбавляют, соответственно, в 40 или 10 раз: 1 объем 2
(1 н) растворы разбавляют, соответственно, в 40 или 10 раз: 1 объем 2  (4 н) раствора кислоты и 39 объемов дистиллированной воды или 1 объем 0,5
(4 н) раствора кислоты и 39 объемов дистиллированной воды или 1 объем 0,5  (1 н) раствора кислоты и 9 объемов дистиллированной воды. Полученный раствор перемешивают и не ранее чем на следующий день устанавливают коэффициент поправки.
(1 н) раствора кислоты и 9 объемов дистиллированной воды. Полученный раствор перемешивают и не ранее чем на следующий день устанавливают коэффициент поправки.
Для определения коэффициента поправки берут несколько отдельных навесок по 0,15 - 0,2 г подсушенного при 150°C карбоната натрия (натрия углекислого безводного), х.ч., с точностью до 0,0002 г. Их количественно переносят с помощью дистиллированной воды в коническую колбу вместимостью 250  так, чтобы объем стал около 25
так, чтобы объем стал около 25  . Затем добавляют 1 - 2 капли раствора метилового оранжевого и титруют из бюретки приготовленным раствором кислоты до перехода желтой окраски в оранжево-розовую. Для определения коэффициента поправки можно использовать тетраборат натрия (буру); навеску берут массой около 0,5 г растворяют и переносят ее в коническую колбу с помощью теплой дистиллированной воды в количестве 30 - 60
. Затем добавляют 1 - 2 капли раствора метилового оранжевого и титруют из бюретки приготовленным раствором кислоты до перехода желтой окраски в оранжево-розовую. Для определения коэффициента поправки можно использовать тетраборат натрия (буру); навеску берут массой около 0,5 г растворяют и переносят ее в коническую колбу с помощью теплой дистиллированной воды в количестве 30 - 60  . Добиваются полного растворения навески. В качестве индикатора применяют раствор метиленового красного с массовой долей 1%. Затем раствор титруют, как и при использовании карбоната натрия.
. Добиваются полного растворения навески. В качестве индикатора применяют раствор метиленового красного с массовой долей 1%. Затем раствор титруют, как и при использовании карбоната натрия.
