Действующий
б) (b) в отношении высокотехнологичных лекарственных препаратов, в которых кровь или компоненты крови используются в качестве исходного сырья в части установления требований к отбору доноров, к качеству и безопасности при заборе, тестировании, обработке, хранении и транспортировке человеческой крови и ее компонентов;
в) (с) для производства и контроля генетически модифицированных организмов, в отношении которых должна быть обеспечена и соблюдена соответствующая изоляция и другие меры защиты на объектах, где осуществляется какая-либо работа с генетически модифицированными микроорганизмами, в целях установления и соблюдения соответствующего уровня биологической безопасности, - такие требования должны соблюдаться.
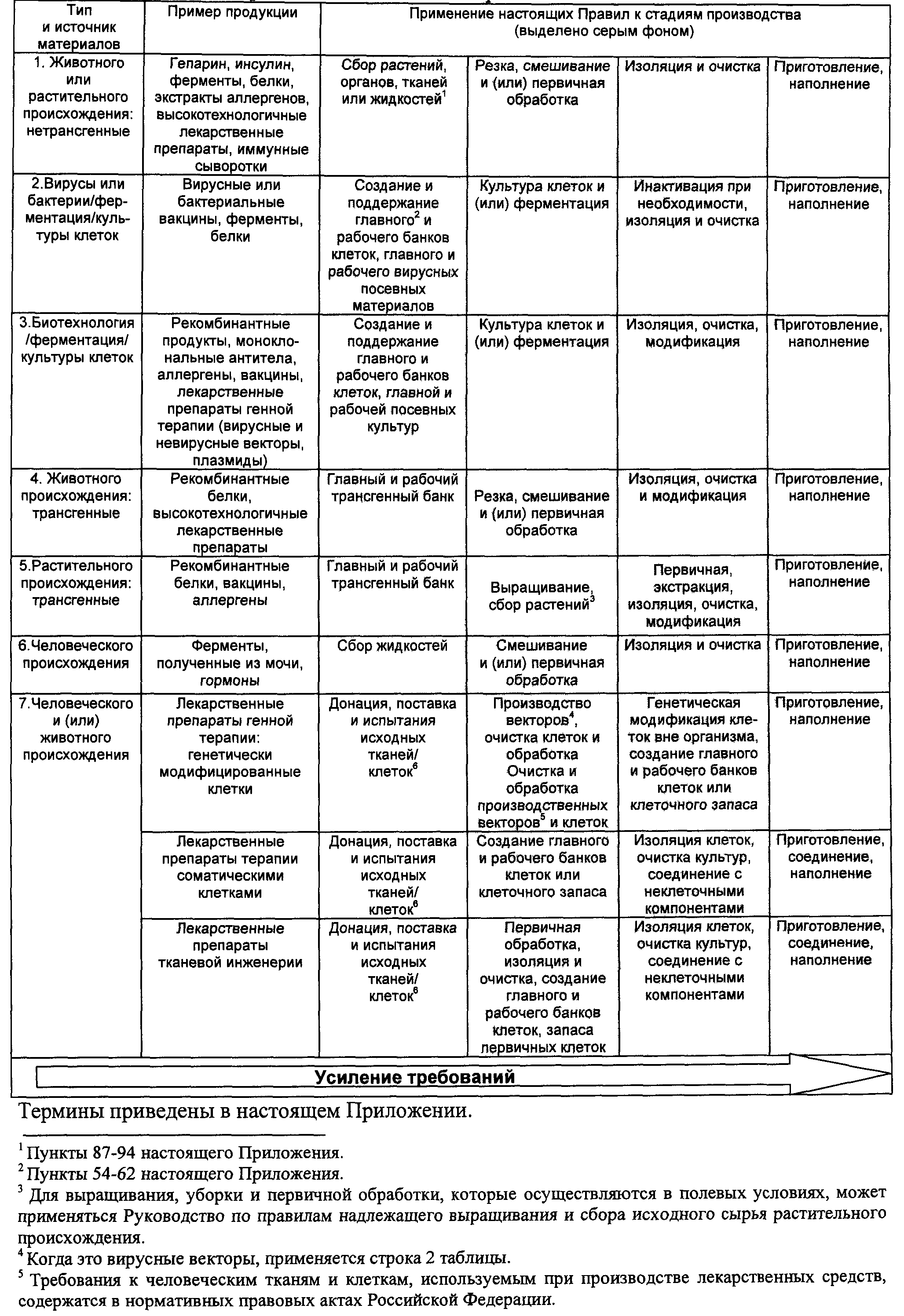
7. Производство биологических фармацевтических субстанций и лекарственных препаратов имеет свою специфику, определяемую характером продукции и технологией производства. Характер производства, контроля и применения биологических лекарственных препаратов требует особых мер предосторожности.
8. В отличие от обычных лекарственных средств, производимых с использованием химических и физических методов, способных демонстрировать высокую степень надежности, производство биологических фармацевтических субстанций и лекарственных препаратов включает в себя использование биологических процессов и материалов, таких как культивирование клеток или экстрагирование материала из живых организмов. Указанные биологические процессы могут демонстрировать свойственную им изменчивость, что приводит к существенному диапазону побочных продуктов различной природы. Поэтому принципы управления рисками для качества особенно важны для данного класса материалов и должны соблюдаться при разработке методов контроля на всех стадиях производства для минимизации вариабельности и уменьшения возможности контаминации и перекрестной контаминации.
9. Материалы, питательные среды и условия культивирования целевых микроорганизмов, культур клеток, вирусов во многом способствуют возможности роста контаминирующих агентов. Многие лекарственные препараты имеют ограниченную устойчивость к широкому спектру методов очистки, в особенности к методам, предназначенным для инактивации или устранения посторонних вирусных контаминантов. Для сведения к минимуму возможности такой контаминации производитель должен уделять основное внимание планированию технологического процесса, конструкции оборудования, помещений, систем обеспечения, условиям приготовления и добавления буферов и реагентов, отбору проб и обучению персонала.
10. Спецификации на продукцию (в частности, спецификации в общих фармакопейных статьях, фармакопейных статьях, регистрационное досье) должны определять, могут ли (и если могут, то до какой степени и до какой стадии) вещества и материалы иметь определенный уровень бионагрузки или же они должны быть стерильными. Производство также должно соответствовать другим требованиям, изложенным в регистрационном досье либо в протоколе клинического исследования (например, количество генераций (удвоений, пассажей) между посевной культурой или банком клеток).
11. Для биологических материалов, которые не могут быть простерилизованы (например, путем фильтрации), производство должно проводиться в асептических условиях для минимизации риска внесения контаминантов. Для регламентации определенных производственных методов, например, для удаления или инактивации вирусов, необходимо руководствоваться соответствующими утвержденными процедурами. Применение соответствующего контроля и мониторинга за состоянием производственной среды, и, где это является возможным, системы уборки и стерилизации "на месте" вместе с использованием закрытых систем может значительно уменьшить риск случайной контаминации и перекрестной контаминации.
12. Контроль включает в себя биологические аналитические методы, которые характеризуются более высокой степенью вариабельности, чем физико-химические методы. Поэтому при производстве биологических фармацевтических субстанций и лекарственных препаратов ключевую роль играет надежный производственный процесс, и особое значение имеет контроль в процессе производства.
13. Биологические лекарственные препараты, в состав которых входят донорские ткани или клетки, как например, определенные высокотехнологичные лекарственные препараты, должны соответствовать требованиям законодательства Российской Федерации в части прослеживаемости, уведомления уполномоченного федерального органа исполнительной власти о неблагоприятных реакциях и клинических случаях в ходе терапии, а также в части технических требований по идентификации, обработке, предохранению, хранению и транспортировке донорских тканей и клеток. Забор материалов и проведение испытаний должны проводиться в соответствии с системой качества, для которой определены стандарты и технические требования.
14. Биологические фармацевтические субстанции и лекарственные препараты должны соответствовать требованиям нормативных правовых актов Российской Федерации в отношении уменьшения риска передачи возбудителя губчатой энцефалопатии животных и латентных вирусов через лекарственные препараты для медицинского применения и для применения в ветеринарии.
15. (1) Персонал, работающий в зонах производства и контроля биологических фармацевтических субстанций и лекарственных препаратов (в том числе персонал, занятый очисткой, обслуживанием или контролем качества), должен проходить обучение и периодическое повторное обучение в соответствии со своими обязанностями и спецификой производимой продукции, включая все особые меры предосторожности для защиты продукции, персонала и охраны окружающей среды.
16. (2) Для обеспечения безопасности продукции должно приниматься во внимание здоровье персонала. Сотрудники, занятые в производстве, техническом обслуживании, проведении испытаний и уходе за животными (в том числе осуществляющие контроль), при необходимости должны быть вакцинированы соответствующими специфическими вакцинами, а также должны проходить регулярные медицинские осмотры.
17. (3) Любые заболевания персонала, которые могут неблагоприятно повлиять на качество продукта, должны препятствовать работе такого персонала в производственной зоне, а соответствующие записи сохраняться. В производстве вакцины БЦЖ и лекарственных препаратов туберкулина могут быть заняты только сотрудники, которые регулярно проходят проверку иммунного статуса или рентгенологическое обследование грудной клетки. Сотрудники должны проходить медицинский осмотр с учетом риска, которому они подвержены. Медицинский осмотр требуется для персонала, работающего с опасными организмами.
18. (4) С целью минимизации возможности перекрестной контаминации необходимо контролировать ограничение движения персонала (в том числе сотрудников службы контроля качества, специалистов по обслуживанию и уборке) на основе принципов управления рисками для качества. Как правило, не допускается переход сотрудников из зон, где возможен контакт с живыми микроорганизмами, генетически модифицированными организмами, токсинами или животными, в зоны, где проводятся работы с другой продукцией, инактивированной продукцией или другими организмами. Если подобных переходов избежать невозможно, должны быть приняты меры для контроля контаминации согласно принципам управления рисками для качества.
19. (5) Степень контроля производственной среды в отношении контаминации частицами и микроорганизмами в производственных помещениях должна соответствовать виду фармацевтической субстанции, промежуточной и готовой продукции и стадии технологического процесса. При этом необходимо учитывать уровень контаминации исходных материалов и степень риска для готового продукта. В программу мониторинга производственной среды должны быть дополнительно включены методы для определения присутствия специфических микроорганизмов (в частности, организма-хозяина, дрожжевых, плесневых грибов, анаэробных микроорганизмов), если на это указывает процесс управления рисками для качества.
20. (6) Производственные и складские помещения должны быть спроектированы с учетом требований к классам чистоты, а процессы спланированы таким образом, чтобы предотвратить контаминацию продукции посторонними веществами. Предотвращение контаминации является более эффективным, чем ее обнаружение и устранение, хотя контаминация может проявиться во время таких производственных процессов, как ферментация и культивирование клеточных культур. Контрольные измерения, включая контроль систем обеспечения и контроль производственной среды, должны проводиться в соответствии с принципами управления рисками для качества на участках, где проходят открытые процессы и продукция может быть подвержена непосредственному воздействию производственной среды (например, во время добавления вспомогательных веществ, сред, буферов, газов, работ во время производства высокотехнологичных лекарственных препаратов). При выборе последовательных классов чистоты в производственных помещениях и соответствующих методов контроля принципы управления рисками для качества должны учитывать принципы, изложенные в соответствующих пунктах Приложения N 1 к настоящим Правилам.
21. (7) Работа с живыми клетками, устойчивыми к среде производственных помещений, должна осуществляться в специально предназначенных производственных помещениях. Если в производстве применяются патогенные микроорганизмы (например, 1 и 2 группы патогенности), то также необходимо использовать только специально предназначенные для этого производственные помещения.
22. (8) Использование одного помещения для производства нескольких лекарственных препаратов может быть разрешено, если перечисленные ниже или эквивалентные факторы и мероприятия (соответственно рассматриваемым типам продукции) являются частью эффективной стратегии контроля, направленной на предотвращение перекрестной контаминации:
а) (а) знание основных характеристик всех клеток, организмов и любых посторонних агентов (например, патогенность, возможность обнаружения, устойчивость, восприимчивость к инактивации), работа с которыми осуществляется в одних и тех же помещениях;
б) (b) при производстве продукции из многочисленных маленьких серий, получаемых из различного исходного сырья (например, лекарственные препараты на основе клеточных технологий) на стадии разработки стратегии контроля должны учитываться такие факторы, как состояние здоровья доноров с целью снижения риска полной потери продукции;
в) (с) предотвращение попадания живых микроорганизмов и спор в смежные помещения или на оборудование путем определения всех потенциальных маршрутов перекрестной контаминации и использования одноразовых компонентов и соответствующих инженерных мероприятий (например, закрытых систем);
г) (d) наличие мероприятий контроля по удалению микроорганизмов и спор перед последующим производством другой продукции. Процедуры очистки и деконтаминации от микроорганизмов и спор должны быть отвалидированы (в том числе для систем отопления, вентиляции и кондиционирования воздуха);
д) (е) если микроорганизмы являются устойчивыми к условиям производственной среды и в распоряжении имеются соответствующие методы, контроль производственной среды, специфический для получаемого микроорганизма, необходимо проводить в смежных зонах во время производства и после завершения очистки и деконтаминации. Также нужно принимать во внимание риски, связанные с использованием определенного контрольно-измерительного оборудования (например, для определения частиц в воздухе) в зонах, где проводятся работы с живыми и (или) спорообразующими микроорганизмами;
е) (f) продукция, оборудование, вспомогательное оборудование (например, для калибровки и валидации) и одноразовые материалы должны перемещаться в пределах предназначенных зон и должны удаляться из этих зон таким образом, чтобы предотвратить контаминацию других зон, другой продукции на различных стадиях производства (в частности, следует предотвратить контаминацию инактивированных продуктов или анатоксинов неинактивированными продуктами);
23. (9) Необходимость наличия специализированных помещений для финишной обработки (в частности, для приготовления, наполнения, упаковки) будет зависеть от перечисленных выше факторов, а также от дополнительных факторов в отношении специфики биологического лекарственного препарата и характеристик другой продукции, включая любые небиологические продукты, производимые в тех же помещениях. На заключительных стадиях могут потребоваться другие меры контроля определенной последовательности добавления веществ, скорости перемешивания, контроля времени и температуры, предельного времени воздействия света и герметизации (изоляции), а также в процедурах очистки в случае пролива (рассыпания).
24. (10) Мероприятия и процедуры, необходимые для обеспечения безопасности производственной среды и персонала, не должны противоречить мероприятиям и процедурам, необходимым для обеспечения качества продукта.
25. (11) Системы воздухоподготовки должны быть спроектированы, сконструированы и обслуживаться таким образом, чтобы исключить риск перекрестной контаминации между различными производственными зонами. Также может возникнуть необходимость в отдельных системах воздухоподготовки для определенных зон. Решение относительно использования систем вентиляции без рециркуляции должно быть принято на основании принципов управления рисками для качества.
26. (12) Работу со стерильной продукцией необходимо вести в зонах с избыточным давлением, но в особых зонах в точках локализации патогенных микроорганизмов необходимо создавать отрицательный перепад давления для предотвращения распространения контаминантов за пределы этих зон. Если для работы в асептических условиях с материалами, составляющими особый риск (например, с патогенными микроорганизмами) используются зоны с пониженным давлением или безопасные боксы, их следует окружать зонами соответствующего класса чистоты с избыточным давлением. Данные перепады давления должны быть четко определены и должны находиться под постоянным контролем с соответствующими настройками аварийной сигнализации.
27. (13) Конструкция оборудования, используемого для работы с живыми микроорганизмами и клетками, включая оборудование для отбора проб, должна исключать возможность контаминации во время проведения работ.
28. (14) Конструкция, обеспечивающая первичную изоляцию, должна исключать риск утечки биологических агентов в непосредственное рабочее пространство, что должно быть подтверждено результатами тестирования с определенной периодичностью.
29. (15) При наличии возможности рекомендуется использовать системы "очистки на месте" и "обработки паром на месте" ("стерилизации на месте"). Конструкция вентилей на ферментаторах должна предусматривать возможность их стерилизации паром.
30. (16) Воздушные фильтры должны быть гидрофобными, срок их службы должен быть определен в процессе валидации путем проверки целостности с определенной периодичностью согласно соответствующим принципам управления рисками для качества.
31. (17) Конструкция дренажных систем должна позволять проводить эффективную нейтрализацию и деконтаминацию сточных вод для исключения риска перекрестной контаминации. Должно быть обеспечено выполнение требований законодательства Российской Федерации с целью минимизации риска контаминации окружающей среды в соответствии с рисками, связанными с биологической опасностью отходов производства.
32. (18) Ввиду изменчивости свойств биологических лекарственных средств или процессов их производства необходимо отмеривать или взвешивать какое-либо соответствующее и (или) критическое исходное сырье (например, питательные среды и буферы) в ходе технологического процесса. В этих случаях в производственной зоне допускается хранение небольших запасов этого исходного сырья на протяжении срока, установленного на основании соответствующих критериев (например, длительность производства серии или длительность кампании).
33. (19) Для производства биологических лекарственных препаратов используются разные виды животных. Можно выделить две большие группы источников:
а) (а) живые животные, объединенные в группы, стада, стаи. Например, обезьяны (вакцина против полиомиелита), лошади, овцы и козы (иммунные сыворотки против ядов змей и столбняка), кошки (аллергены), кролики, мыши и хомяки (вакцина против бешенства), козы, крупный рогатый скот (трансгенные продукты);
б) (b) ткани и клетки животного происхождения, извлеченные из умерщвленных животных (овцы и свиньи), используемые для производства высокотехнологичных лекарственных препаратов или как сырье для ферментов, антикоагулянтов и гормонов.
34. Животные также используются для контроля качества в соответствии со спецификациями (пирогенность, токсичность, безвредность, специфическая активность).
35. (20) В дополнение к выполнению нормативных требований в отношении губчатой энцефалопатии животных, другие опасные агенты (возбудители зоонозов, антропозоонозов животных) должны контролироваться и регистрироваться согласно постоянно действующей программе мониторинга. Для организации таких программ необходимо получать консультацию соответствующего специалиста. В случаях заболевания животных-доноров или животных, которые используются в качестве сырья, должны быть проведены и зарегистрированы соответствующие исследования на предмет пригодности этих животных и пригодности животных, пребывавших в контакте с больным животным, для использования при производстве (в качестве исходных материалов или исходного сырья), при контроле качества продукции и при проведении испытаний на безопасность. Должна быть разработана процедура ретроспективного анализа, позволяющая принимать решение относительно годности биологической фармацевтической субстанции или лекарственного препарата, в состав которого входит или при производстве которого использовался такой материал животного происхождения в качестве исходного материала или исходного сырья. Для установления того, какая из донаций последней показала отрицательный результат на наличие заболевания, там где применимо, проводится повторное тестирование образцов, сохраненных при предыдущем взятии материала от того же животного-донора (если таковые имеются), что влияет на процесс принятия данного решения. При определении периода изъятия животных из программы должен учитываться период выведения лекарственных средств, использовавшихся для введения животным-донорам или животным, которые использовались в качестве сырья, что должно быть оформлено документально.
36. (21) Особое внимание необходимо уделять предотвращению и мониторингу инфекционных заболеваний у животных, которые используются в качестве сырья, и у животных-доноров. Принимаемые меры должны включать контроль источников, помещений, пастбищ, контроль биологической безопасности, режимов проведения испытаний, контроль вспомогательных материалов и кормов для животных. Особенную значимость имеют проверки животных, свободных от специфических патогенов. Должны быть определены требования к содержанию и мониторингу здоровья других животных (например, живущих в стаях или стадах).
37. (22) Для лекарственных препаратов, произведенных с использованием трансгенных животных, должна быть обеспечена отслеживаемость исходных животных, использованных для создания из них трансгенных животных.
38. (23) Особое внимание должно быть уделено выполнению требований нормативных правовых актов Российской Федерации, регулирующих вопросы защиты животных, используемых в экспериментальных целях, в отношении вивариев, в которых содержатся животные, ухода за животными и карантина. Виварии, в которых содержатся животные, используемые для производства и контроля качества биологических фармацевтических субстанций и лекарственных препаратов, должны быть отделены от зон производства и контроля качества.