Действующий
1) удовлетворяет жалобу, в том числе в форме отмены принятого решения, исправления допущенных органом, предоставляющим государственную услугу, опечаток и ошибок в выданных в результате предоставления государственной документах, возврата заявителю денежных средств, взимание которых не предусмотрено нормативными правовыми актами Российской Федерации, а также в иных формах;
134. Не позднее дня, следующего за днем принятия решения, заявителю направляется мотивированный ответ о результатах рассмотрения жалобы в общеустановленном порядке в письменной форме и, по желанию заявителя, в электронной форме.
135. В случае установления в ходе или по результатам рассмотрения жалобы признаков состава административного правонарушения или преступления должностное лицо, наделенное полномочиями по рассмотрению жалоб, незамедлительно направляет имеющиеся материалы в органы прокуратуры.
136. В ходе личного приема заявителю может быть отказано в дальнейшем рассмотрении обращения, если ему ранее был дан ответ по существу поставленных вопросов.
138. Заявители имеют право обратиться в Министерство за получением информации и документов, необходимых для обоснования и рассмотрения жалобы.
139. Информирование заявителей о порядке подачи и рассмотрения жалобы осуществляется в соответствии с пунктом 4 Административного регламента.
Приложение N 1
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения,
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения,
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
1 | Наименование и адрес заявителя и (или) производителя лекарственного препарата и адрес места осуществления производства лекарственного препарата | ||
2 | Наименование лекарственного препарата (международное непатентованное или химическое и торговое наименования) | ||
3 | Перечень веществ, входящих в состав лекарственного препарата, с указанием количества каждого из них | ||
4 | Лекарственная форма, дозировка, способы введения и применения, срок годности лекарственного препарата | ||
5 | Описание фармакологических и фармакодинамических или иммунобиологических свойств лекарственного препарата | ||
6 | Заявленная производителем лекарственного препарата предельная отпускная цена на лекарственный препарат, включенный в перечень жизненно необходимых и важнейших лекарственных препаратов, в случае его государственной регистрации | ||
7 | Отсутствие необходимости проведения клинического исследования, исследования биоэквивалентности лекарственного препарата, разрешенного для медицинского применения на территории Российской Федерации более двадцати лет, с указанием нормативных правовых актов, подтверждающих данный срок применения | ||
N | Наименование документа | Количество страниц |
1 | Проекты макетов первичной упаковки и вторичной (потребительской) упаковки лекарственного препарата | |
2 | Документ, переведенный на русский язык, подтверждающий соответствие производителя регистрируемого лекарственного препарата требованиям правил организации производства и контроля качества лекарственных средств, выданный компетентным органом страны производителя регистрируемого лекарственного препарата и заверенный в установленном порядке | |
3 | Проект нормативной документации на лекарственный препарат либо указание соответствующей фармакопейной статьи | |
4 | Схема технологического процесса производства лекарственного препарата, ее описание и (или) схема технологического процесса производства фармацевтической субстанции, ее описание | |
5 | Документ, переведенный на русский язык, подтверждающий соответствие производителя фармацевтической субстанции требованиям правил организации производства и контроля качества лекарственных средств, выданный компетентным органом страны производителя фармацевтической субстанции, заверенный в установленном порядке | |
6 | Документ, содержащий сведения о показателях качества фармацевтической субстанции, используемой при производстве лекарственных препаратов | |
7 | Нормативная документация на фармацевтическую субстанцию либо указание соответствующей фармакопейной статьи | |
8 | Информация об условиях хранения, перевозки лекарственного препарата и иная информация | |
9 | Отчет о результатах доклинического исследования лекарственного средства для медицинского применения, содержащий описание, результаты и статистический анализ результатов данного доклинического исследования | |
10 | Проект протокола клинического исследования лекарственного препарата для медицинского применения | |
11 | Брошюра исследователя | |
12 | Информационный листок пациента | |
13 | Информация о выплатах и компенсациях пациентам (здоровым добровольцам, больным) (далее - пациенты), привлеченным к проведению клинических исследований лекарственного препарата для медицинского применения, исследований биоэквивалентности и (или) терапевтической эквивалентности | |
14 | Отчет о результатах международных многоцентровых клинических исследований лекарственного препарата для медицинского применения, часть из которых проведена на территории Российской Федерации | |
15 | Проект инструкции по применению лекарственного препарата | |
16 | Переведенная на русский язык и заверенная в установленном порядке копия документа, подтверждающего регистрацию лекарственного препарата в случае его регистрации вне пределов Российской Федерации | |
17 | По желанию заявителя могут быть представлены отчеты о проведенных в стране заявителя и других странах результатах клинических исследований, исследований биоэквивалентности и (или) терапевтической эквивалентности лекарственного препарата (включая эпидемиологические или эпизоотологические исследования иммунобиологических лекарственных препаратов, предназначенных для иммунологической профилактики и лечения инфекционных заболеваний, в том числе у детей), содержащие описания проведенных исследований лекарственного препарата, их результаты и статистический анализ полученных результатов |
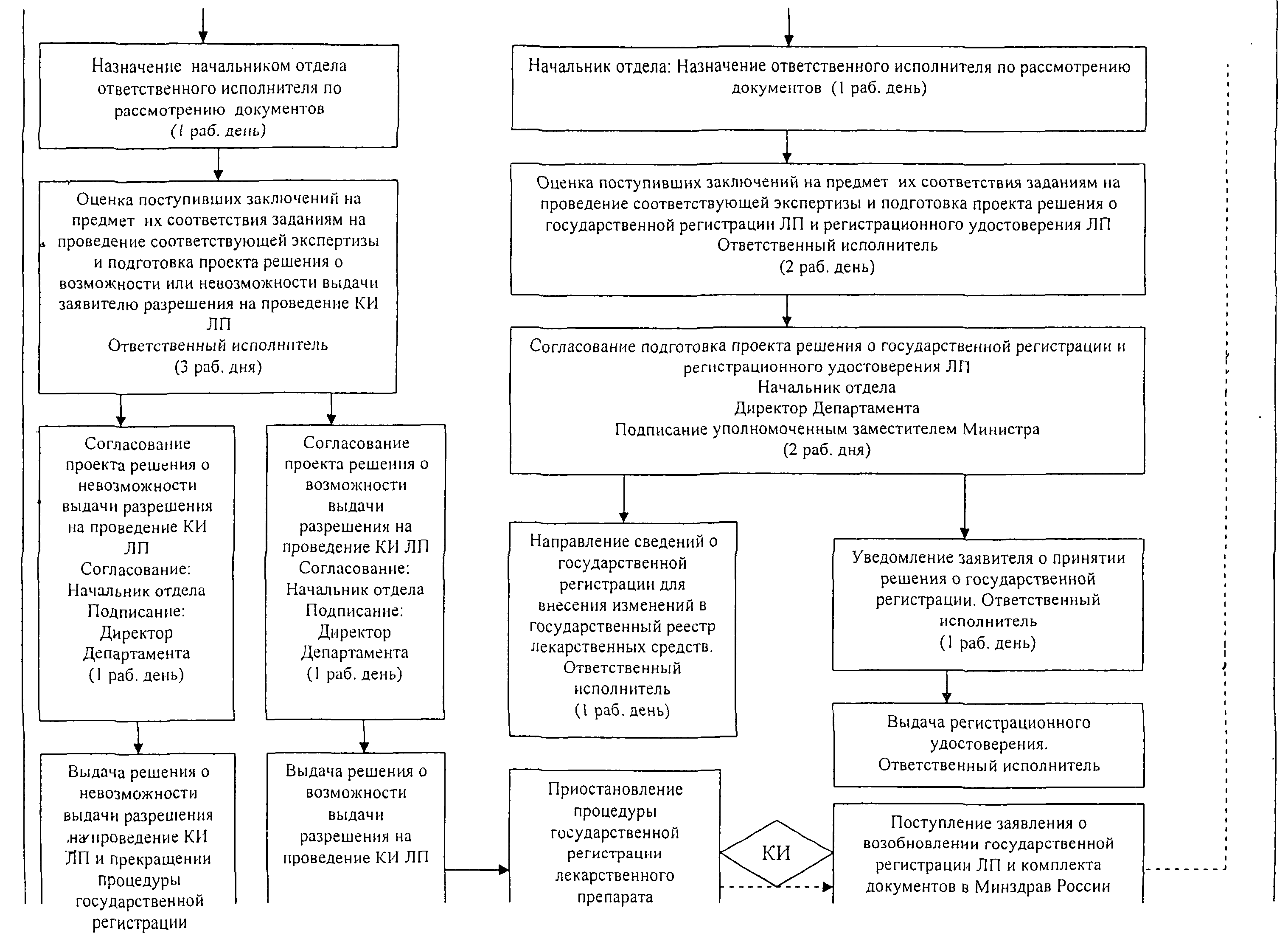
Приложение N 2
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
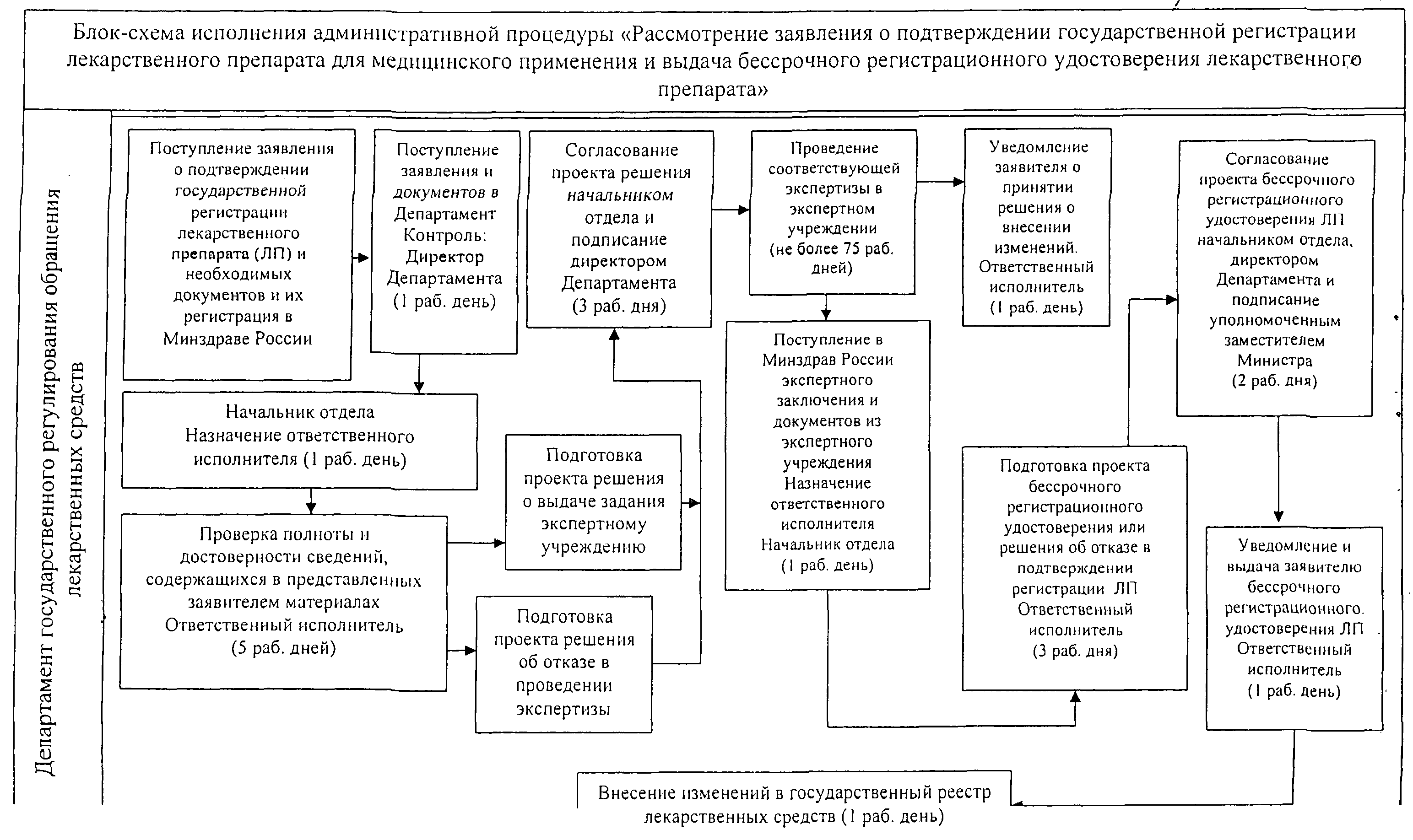
Приложение N 3
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
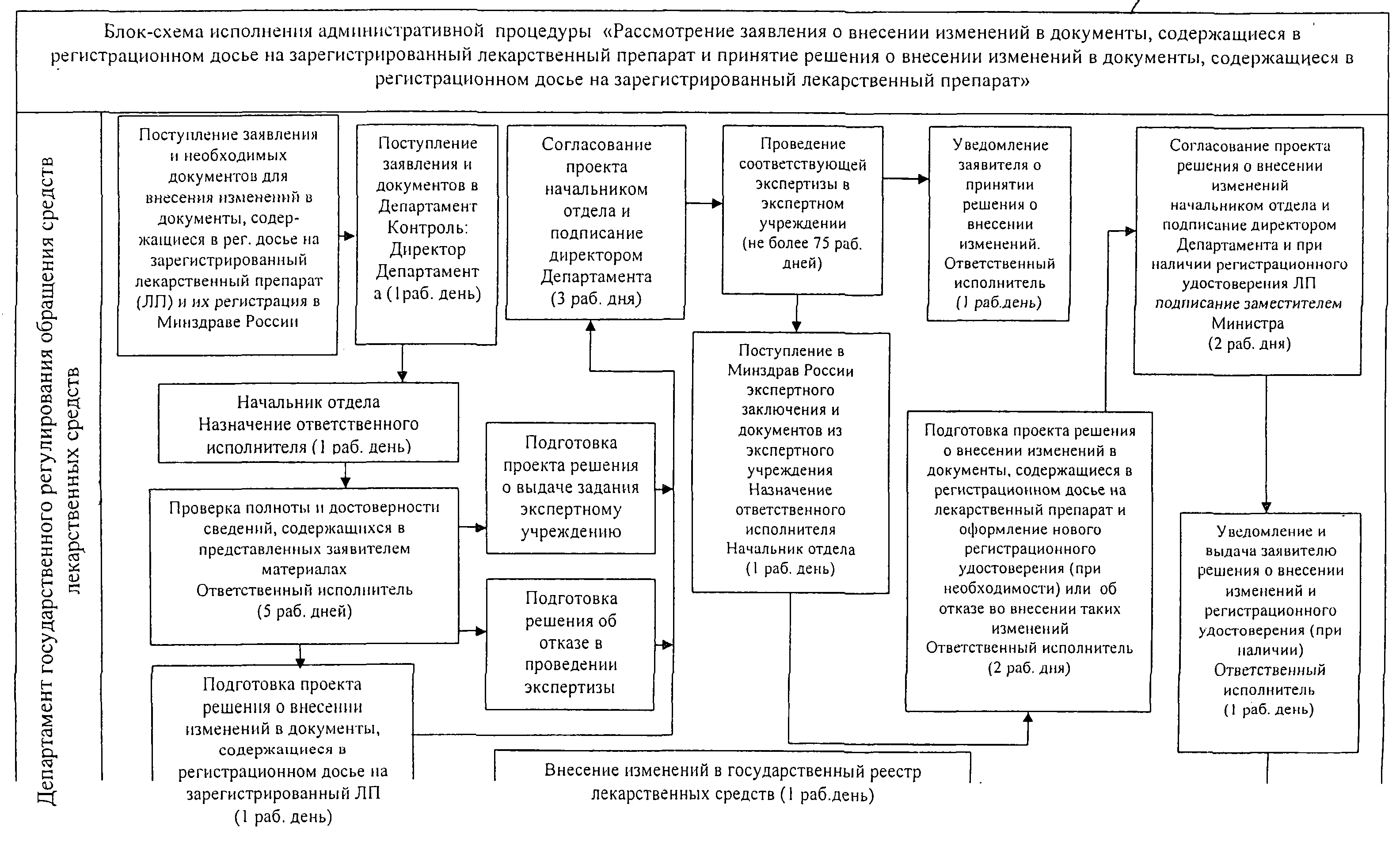
Приложение N 4
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
Приложение N 5
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н
к Административному регламенту
по предоставлению государственной
услуги по государственной регистрации
лекарственных препаратов для
медицинского применения
утв. приказом Министерства здравоохранения РФ
от 22 октября 2012 г. N 428н